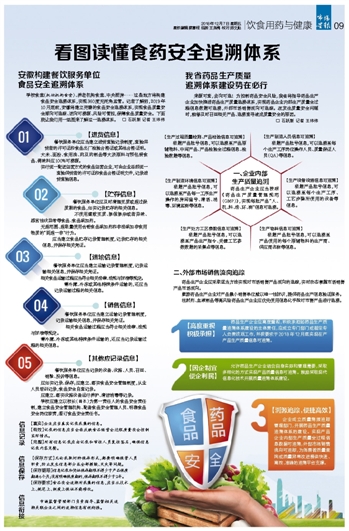
来源可查,去向可追!为控制药品安全风险,我省将指导药品生产企业加快推进药品生产质量追溯体系,实现药品企业内部生产质量全过程信息数据可追溯,外部市场销售流向可追踪。在发生质量安全问题时,能够及时召回相关产品、追溯查寻造成质量安全的原因。
一、企业内部
生产质量追溯
药品生产企业应当按照《药品生产质量管理规范(GMP)》,实现每批产品“人、机、料、法、环、测”信息可追溯。
【生产过程质量检测、产品检验信息可追溯】
根据产品批号信息,可以追溯至产品原辅物料、中间产品、产品检验全过程信息、检验数据等信息。
【生产制造人员信息可追溯】
根据产品批号信息,可以追溯至每个生产工序岗位操作人员、质量保证人员(QA)等信息。
【生产制造环境信息可追溯】
根据产品批号信息,可以追溯至产品每一工序生产操作的房间编号、清场、消毒、环境监测等信息。
【生产设备设施信息可追溯】
根据产品批号信息,可以追溯至每个生产工序、工艺步骤所使用的设备等信息。
【生产处方工艺参数信息可追溯】
根据产品批号信息,可以追溯至产品生产指令、关键工艺参数数据的采集点等信息。
【生产物料信息可追溯】
根据产品批号信息,可以追溯至产品使用的每个原辅物料的生产商、供应商名称等信息。
二、外部市场销售流向追踪
药品生产企业应采取适当方法实现对市场销售产品流向的追踪,实时动态掌握市场销售产品市场流向。
鼓励药品生产企业对产品最小销售单位赋以唯一性标识,提供药品生产信息验证服务。
注射剂、血液制品等高风险药品生产企业应优先使用信息化手段对市售产品进行追溯。